Responder a las siguientes preguntas
1) ¿Cual es el Elemento Químico que en la Tabla Periódica de los Elementos Representativos ( TPER) pertenece al Grupo III y al Período 2 ?
2) ¿ Cuantos electrones posee en su capa mas externa el Elemento Cloro (Cl) ?
3) ¿Cuantos elementos estan ubicados en el Período 1?
4) ¿Cuantos elementos estan ubicados dentro del Peródo 2 ?
5) ¿Cuantos elementos estan ubicados dentro del Período 3?
6)¿Cuantos electrones poseen en su capa mas externa los elementos del Grupo II?
7) ¿Cuantos electrones poseen en su capa más externa los elementos del Grupo VII ?
8) En un Laboratorio se ha encontrado una Sustancia metálica.Al analizar su estructura electrónica se encuentra que posee 3 capas de electrones.¿Que elemento/s podria/ n ser?
9) Al calentar un material desconocido se desprende un gas.Al tratar de combinar el gas que se desprendió con Fluor y con Potasio no se obtiene ninguna sustancia.A partir de la estructura electrónica se concluye que posee 2 capas de electrones.¿De que Elemento puede tratarse?
10) En el ORDENAMIENTO de la TPER
¿Cual es el Gas Inerte mas cercano al elemento Litio ( Li)? ¿Cual es el Gas Inerte mas cercano al Hidrógeno (H )? ¿Cual es el Gas Inerte mas cercano al Oxígeno( O)? ¿ Cual es el Gas Inerte mas cercano al Cloro ( Cl)?
11) Supongamos que un átomo de Cloro gana ( adquiere ) 1 electron.Con que carga electrica quedaria? ¿Se convertiria en un Anion ó en un Cation ? La configuracion electrónica resultante seria igual a la de qué elemento?
12) Supongamos que un átomo de Litio pierde un electrón ,su configuración electrónica resultante seria igual a la de que Elemento? ¿Con que carga electrica quedaría?¿Se convertiria asi en un Anión ó en un Cation?
13) ¿Cuantos electrones deberia ganar ( adquirir) el elemento Oxígeno para obtener la configuración electrónica similar a la del Neon( Ne)?
14) El elemento Magnesio , si pierde 2 electrones , adquiere la configuración electronica de qué Elemento? ¿Se transforma en un Anión ó en un Cation?
15) A partir de lo que se vio hasta ahora en los contenidos de la materia , pensar lo siguiente:
En cinco recipientes ( A, B,C,D,E) se tienen IGUAL cantidad ( en masa ) de átomos de 5 Elementos diferentes.A cada recipiente le corresponde uno solo de los siguientes Elementos: Hidrógeno, Litio, Azufre,Cloro, Aluminio.Se pesan los recipientes y todos pesan lo mismo ( dijimos que en todos hay la misma masa).
Ordenar los recipientes de segun la CANTIDAD ( de mayor a menor en numero) de átomos que poseen.
viernes, 29 de mayo de 2020
viernes, 22 de mayo de 2020
Los atomos y sus Capas electronicas
A travez de los ultimos capitulos vimos que los electrones se ubican por fuera del nucleo y se explico a travez de razonamientos y ejercicios como es que un átomo puede ser electricamente Neutro ó ser un Ion.Ahora vamos a ver como es que el electrón se mantiene lejos del átomo sin ser atraido hacia el núcleo, para eso vamos a ver para ello primero vamos a ver que son la Fuerza Centripeta y la Fuerza Centrífuga.El movimiento del electron alrededor del nucleo es lo que contrarresta la Fuerza electrica de atraccion que ejerce el nucleo hacia el.
En esta imagen vemos como las fuerzas opuestas ( representadas por flechas) son iguales y opuestas y se cancelan.
Dijimos que para este curso nos dedicariamos a estudiar el "modelo de Bohr" de los átomos entonces vamos a suponer que los electrones se ubican en CAPAS que vamos a llamar Capa 1 , Capa 2 , Capa 3 , Capa 4 , etc.Esas capas a su vez tienen sub-capas pero no vamos a detenernos en eso.
En cada capa entra ( puede existir ) un cierto Numero MAXIMO de electrones , es decir No mas que cierta cantidad y eso depende de la Capa.
En la capa 1 ( la mas cercana al Nucleo) entran hasta (COMO MAXIMO ) dos electrones
En la capa 2 ( la que le sigue hacia afuera) entran hasta ocho electrones
En la Capa 3 entran hasta dieciocho electrones
En la capa 4 entran hasta treinta y dos electrones
Aclaracion : Cuando digo que "entran hasta" significa que puede haber HASTA ese número de electrones , no mas , pero puede haber menos.
K, L, M, N son otras denominaciones que se les dan a las Capas 1 , 2 , 3 y 4 respectivamente.En la imagen se muestra tambien el Numero Maximo de electrones que puede haber en cada una de las capas.El numero de electrones que puede entrar ( que caben) es mayor a medida que la capa se encuentra mas lejos del Nucleo porque hay mas ESPACIO para que esten los electrones.
Recordar " cargas de ... signo se ... "
Vamos a ver como se van "llenando" las capas a medida que aumenta el valor de Z
Los circulos negros simbolizan los electrones que posee cada atomo de cada elemento .Vemos que se van agregando de a uno a medida que aumenta de a uno el numero de protones.Al llegar a tener 2 electrones en el primer PERIODO ( 1) se dice que "adquirió la "CONFIGURACION ELECTRONICA" del Gas INERTE ( Helio) cuando completó con 2 electrones la primera Capa.
.Pasa entonces a comenzar llenarse la SEGUNDA CAPA ( periodo 2 ) empezando por el Li ( Litio) ,nuevamente se va agregando un electron por cada proton y asi se llega hasta que se adquiere la CONFIGURACION ELECTRONICA del Neon (se completo la capa con 8 electrones) .El nueve elemento Na ( Sodio) comienza a llenar su 3ra Capa y asi hasta llegar a tener 8 electrones en el caso el Ar ( Argon).
Una vez que la 3 er Capa adquirió la Configuracion del Ar ( Argon) comienza a llenarse la 4ta Capa empezando por el elemento K ( Potasio) , sigue el Ca ( Calcio) y nos detenemos aqui.
Podriamos preguntarnos ¿Por que los Elementos Helio, Neon, Argon, Kripton, Xenon, son llamados "GASES INERTES"? Bueno, como ya dijimos estos elementos son MUY POCO REACTIVOS ( significa que es muy dificil hacer que se COMBINEN con otros elementos ) y eso lo que esta reflejando es que tener esa CONFIGURACION ELECTRONICA los hace MUY ESTABLES:
Ahora que vimos como se van completando las Capas de los átomos fijense en la Tabla Periodica de los Elementos el Número Romano que hay arriba de las Columnas y tambien fijense el Numero de los Períodos respectivos.Qué notan?
domingo, 17 de mayo de 2020
¿De donde salieron los Elementos? Como se formaron?

Los Pilares de la Creación es una fotografía tomada por el telescopio espacial Hubble de trompas de elefante de gas interestelar y polvo en la nebulosa del Águila, a unos 6 500 años luz de la Tierra.Estas aglomeraciones son llamadas así porque el gas y el polvo que las forman se encuentra en el proceso de creación de nuevas estrellas, mientras que también está siendo erosionado por la luz de las estrellas cercanas que se han formado recientemente.Tomada el 1 de abril de 1995, fue nombrada una de las diez mejores fotografías del Hubble por Space.com.Los astrónomos responsables de la foto fueron Jeff Hester y Paul Scowen, ambos de la Universidad Estatal de Arizona.
En este video vemos la explicación de un Astrofísico acerca de la formacion de Elementos en una etapa inicial de la formacion de un Estrella
En este otro video se explica la formación de Elementos mas pesados en estrellas mas grandes
La siguiente imagen muestra a la "nebulosa de la Cabeza de caballo" , otro sitio de formacion de estrellas ubicado a 1200 años luz de distancia de La Tierra.
Para saber algo massobre las Nebulosas en este link
sábado, 16 de mayo de 2020
Tablas Periodicas Interactivas
Hay varios sitios de Internet donde pueden consultarse Tablas Periodicas y obtener informacion sobre cada Elemento como ser Usos, propiedades físicas, compuestos quimicos que forman etc.Haciendo Click en cada elemento se obtiene la información.
En esta otra ( en Ingles) se pueden ver los usos y algunos datos de cada Elemento
Algunas Tablas Periodicas Alternativas
viernes, 15 de mayo de 2020
Las "Tablas Periodicas de los Elementos"
Para los fines de este curso elemental de Quimica vamos a ver primero la Tabla llamada " de los Elementos Representativos" ó " de los Elementos del Grupo Principal" ( son los Elementos mas Abundantes) que se ve en la Imagen anterior.Alli estan ordenados algunos de los Elementos ,conocidos,segun su Numero Atomico Z creciente .Fijense el Numero que hay arriba de cada Simbolo Quimico respectivo. La secuencia es Hidrogeno, Helio, Litio, Berilio , Boro, Carbono, Nitrogeno, Oxigeno , Fluor, Neon, Sodio,Magnesio, Aluminio, Silicio, Cloro, Argon, Potasio, Calcio , etc Con estos Elementos vamos a trabajar en adelante.
En el Borde superior estan ubicados Numeros Romanos ,son los "Grupos" de la Tabla y vemos que van del IA al VIIIA. En el Borde a la Izquierda vemos numeros arabigos del 1 al 7 , son los "Períodos" de la Tabla.Entonces , las columnas verticales contienen a los Elementos de cada GRUPO y las Hileras horizontales contienen a los Elementos de cada Período.
En la imagen de arriba vemos otra Tabla Periodica donde se muestra la ubicación de los Metales ( Celeste) , los Metaloides( Verde) , los No metales ( Amarillo) y los llamados " Gases Nobles o Inertes" ( Naranja).
En esta representacion vemos como el ORDENAMIENTO en base al valor de Z permite ver que hay una periodicidad en las propiedades "metal-metaloide-no metal -gas inerte".Esa es UNA de las propiedades que muestran periodicidad.
Tradicionalmente se nombra a los Elementos del Grupo IA como los " Metales alcalinos", al Grupo IIA como el de los " Metales Alcalino Terreos" , a los del Grupo VII como el de los " Halógenos" y al VIII A como el de lo "Gases Inertes". Los otros grupos tambien tienen nombres pero no suelen usarse.En la siguiente Imagen se muestra el nombre que se les da a esas Familias ó Grupos de Elementos.
En el primer video ( esta en Ingles la explicacion del Docente) vemos algunas propiedades del Elemento Hidrógeno , veremos que es un gas incoloro, combustible , menos denso que el aire y que por reaccion con el Oxigeno genera el Agua.En la demostración de laboratorio el gas Hidrógeno se encuentra en el cilindro metalico de la izquierda y el Docente lo transfiere a tubos de ensayo invertidos para que quede atrapado en ellos.Luego los acerca a una llama y el gas detona al combinarse con el Oxígeno del aire.Finalmente el recipiente mas grande se puede ver que se generó agua a travez de la reaccion ( se ve que quedo empañado).
El Hidrogeno se empleo en las primeras aeronaves ( Dirigibles) por ser mas liviano que el aire perodebido a su combustibilidad y capacidad para estallar tuvo que ser abandonado despues de algunas tragedias como se pudo ver en el caso del Dirigible Hindenburg.
El el siguiente Video podemos ver la reaccion de los Metales del grupo IA con el agua , les aclaro que esos trozos de metal que estan en frascos, estan guardados bajo un aceite especial ó en una atmosfera libre de aire ( no es agua) como van a ver en el experimento.
En este otro Video podemos ver como una cinta de Magnesio ( Metal Alcalino Terreo del Grupo IIA) se quema en el aire..El Magnesio no reacciona vigorosamente con el agua pero como vemos basta la llama de un encendedor comun para que se encienda y reaccione con el oxígeno del aire.
En este otro video ( esta en Ingles pero se entiende) se pueden ver algunas reacciones de Fluor, Cloro, Bromo y Iodo con el Hidrogeno y con el Aluminio y ademas vemos el aspecto que tienen esos elementos del Grupo VII A.
Los denominados " Gases Nobles" ó mas actualmente " Gases Inertes" tienen la característica de ser MUY POCO Reactivos , es decir es dificil ( no imposible) hacer que se combinen con otros Elementos.Ya vamos a ver a que se debe esto y ¿por que estan en el ULTIMO grupo de la Clasificación Periodica de los Elementos?
En este video veremos las aplicaciones de los Gases Inertes
jueves, 14 de mayo de 2020
La Clasificación Periodica de los Elementos
Lo que Mendeleyev descubrió fue que las propiedades Quimicas ( como se combinaban) y Fisicas de los Elementos seguian cierta Periodicidad al ordenarlos segun Z ( en realidad el los ordenaba segun A ( masa Atomica ó Peso Atomico ).Eso le habia permitido ordenarlos en hileras y en Grupos (Columnas) y se verificaba asi que se podian obserbar una periodicidad en las propiedades.A continuacion se presenta la Tabla Periodica de 1872 , una modificacion de su propuesta de 1869.
A la luz de lo que se conoció sobre la Estructura Atómica a partir de comienzos del Siglo XX con el Modelo de Bohr vamos a explicar el por que de este ordenamiento y la periodicidad de las propiedades de los Elementos.Cuando Mendeleyev propuso su "tabla" , muy pocos científicos creian en la existencia de los átomos y por supuesto nadie sabia de la existencia de Protones, Electrones y Neutrones.Su descubrimiento lo hizo a partir de deducciones , del trabajos e ideas de Quimicos que lo precedieron y de la acumulación de datos que se habia logrado para ese entonces.Algunos de los Quimicos que lo precedieron y que fueron haciendo aportes para que el llegara a proponer este ordenamiento son Antoine Lavoisier,Wolfgang Dobereiner,Leopold Gmelin, Jean Dumas,Alexandre Chancourtois,Lothar Meyery John Newlands.
Elementos Quimicos Clasificacion
Una primera Clasificación de los Elementos ( recordar que son Sustancias Simples), consistio en agruparlos segun ciertas características comunes .
Una Clasificación sencilla fue agruparlos en : Metales, No Metales y Metaloides ó Semimetales
En este cuadro vemos las caracteristicas correspondientes
Aclaración : Hg( mercurio) Cs( Cesio) , Fr( Francio) y Ga( Galio) son metales liquidos a temperatura ambiente
Una vez que se pudo tener unas decenas de Elementos purificados fue posible encontrar relaciones entre ellos, que permitieran agruparlos con mayor precisión y sistematizar sus características.
En este video podemos ver el caso del Elemento Mercurio , brillante, liquido
Aqui podemos ver algunosexperimentos que muestran propiedades de los metales
En este video podemos ver la conduccion del calor de dos metales, cobre y hierro
Hacia 1860 ya se habia logrado identificar 51 Elementos distintos , eso permitio a varios Quimicos encontrar relaciones entre ellos que culminaron con el ordenamiento conocido como "Tabla Periódica de los Elementos" elaborada por el Quimico Ruso Dmitri Ivánovich Mendeléyev ( 1834 - 1907 ) en 1869 .
En el Capitulo siguiente veremos como se relaciona la Estructura atómica con la "Tabla de Mendeleyev"
Una Clasificación sencilla fue agruparlos en : Metales, No Metales y Metaloides ó Semimetales
En este cuadro vemos las caracteristicas correspondientes
Una vez que se pudo tener unas decenas de Elementos purificados fue posible encontrar relaciones entre ellos, que permitieran agruparlos con mayor precisión y sistematizar sus características.
En este video podemos ver el caso del Elemento Mercurio , brillante, liquido
Aqui podemos ver algunosexperimentos que muestran propiedades de los metales
En este video podemos ver la conduccion del calor de dos metales, cobre y hierro
Hacia 1860 ya se habia logrado identificar 51 Elementos distintos , eso permitio a varios Quimicos encontrar relaciones entre ellos que culminaron con el ordenamiento conocido como "Tabla Periódica de los Elementos" elaborada por el Quimico Ruso Dmitri Ivánovich Mendeléyev ( 1834 - 1907 ) en 1869 .
En el Capitulo siguiente veremos como se relaciona la Estructura atómica con la "Tabla de Mendeleyev"
martes, 12 de mayo de 2020
Energía Nuclear
Como vimos , una de las reglas que rigen la interaccion entre cargas eléctricas era " cargas de distinto signo se atraen y cargas de igual signo se repelen " , tambien vimos que el Nucleo atómico es un espacio muy pequeño dentro de( a su vez) un átomo muy pequeño.Como es posible entonces que los protones no se repelan entre sí?
Se postula que la la razon está en la existencia de los Neutrones y la fuerza que atrae neutrones y protones se llama " fuerza nuclear" , a distancias cortas predomina sobre la fuerza electrica que de otra forma los haria repeler entre si .De todas formas existe un límite para la cantidad de protones que puede haber en el núcleo sin que se DESINTEGRE expontáneamente y tambien debe haber una cierta proporción entre protones y neutrones en el mismo.La desintegración de los átomos es la fuente de la RADIOACTIVIDAD por consiguiente es posible hacer que el nucleo de un átomo sea INESTABLE alterando la cantidad de neutrones que posee.Ese es el modo de producir REACCIONES NUCLEARES de FISION que son las que se emplean en los Reactores Nucleares y en las Armas Atómicas.Uranio-235 y Plutonio -239 son los Isotopos mas empleados para hacer funcionar reactores Nucleares y Artefactos Explosivos Atomicos.
De donde sale esa Energía? Es la diferencia entre la cantidad de Energía que tenia el Nucleo inicial y el la que poseen los Nucleos resultantes de la Fision , estaba almacenada como Energía potencial de Union.La energia que se libera en estas reacciones es muy grande , en la siguiente formula se expresa la relación que hay entre la Masa ( m) y la Energia ( E) donde "c" es la velocidad de la luz.Como el valor de "c" ( velocidad de la luz) es muy grande y ademas esta elevado al cuadrado , resulta que la conversion de masa a Energia que ocurre da por resulttado una cantidad muy grande.
En el siguiente videopodemos ver una animacion de una reaccion de fision en cadena , los neutrones estan representados como esferas rojas.Notar que al no tener carga eléctrica los neutrones pueden acercarse a los nucleos de los a´tomos sin ser repelidos.
En el siguiente video podemos ver el funcionamiento de un reactor nuclear de fision utilizado en la generacion de energía eléctrica
En este otrovideo se recorren las instalaciones de la Central Nuclear de Atucha en la provincia de Buenos Aires , existe otra Central Nuclear en la localidad de Rio Tercero Provincia de Cordoba.
Los diferentes Nucleidos de un mismo Elemento ( se llaman ISOTOPOS y ya vimos el caso d e los 3 isotopos del Elemento Hidrógeno) pueden se "Estables" o "Inestables".
Los Isotopos Inestables ó "radiactivos" tinen muchisimas aplicaciones en Medicina , Industria e Investigación.
En el siguiente video podemos apreciar algunas aplicaciones de los Isotopos radioactivos se aprovecha en algunos casos que poseen las mismas propiedades quimicas que el correspondiente elemento estable ligada a la facil detección debido a la radioactividad que emiten.El contenido de Carbono-14 se emplea para determinar la antiguedad de fosiles.
En este otrovideo se explica el uso de isotopos radioactivos en las "centellografias"
Aqui podemos ver una explicacion acerca de las principales radiaciones emitidas por aquellos nucleidos que son atomos radioactivos. Tambien existen nucleidos que emiten Rayos X.
En este otro video se muestra una recopilacion historica sobre el desarrollo de las primeras bombas atómicas.
El elemento ( natural) que posee mas protones es el Uranio justamente porque más protones hacen mas inestables a los átomos , no es que no puedan existir pero su vida se hace mas corta pues desintegran.Si se tiene en cuenta que el Sistema Solar existe desde hace 4600 millones de años , es imposible que pueda haber en la Tierra elementos que tengan corta vida.Sin embargo existen Elementos ARTIFICIALES producidos en laboratorios que poseen mas protones que el Uranio se llaman "Elementos Transuránicos".Esos Elementos Transuránicos ( mas alla del Uranio) tienen " vidas medias" del orden de milisegundos , esto significa que la mitad de los átomos inicialmente presentes se desintegra en ese cortisimo tiempo.
El Elemento Transuránico mayor valor de Z se pudo sintetizar a la fecha ( 20020 ) posee 118 protones.
De donde sale esa Energía? Es la diferencia entre la cantidad de Energía que tenia el Nucleo inicial y el la que poseen los Nucleos resultantes de la Fision , estaba almacenada como Energía potencial de Union.La energia que se libera en estas reacciones es muy grande , en la siguiente formula se expresa la relación que hay entre la Masa ( m) y la Energia ( E) donde "c" es la velocidad de la luz.Como el valor de "c" ( velocidad de la luz) es muy grande y ademas esta elevado al cuadrado , resulta que la conversion de masa a Energia que ocurre da por resulttado una cantidad muy grande.
En el siguiente videopodemos ver una animacion de una reaccion de fision en cadena , los neutrones estan representados como esferas rojas.Notar que al no tener carga eléctrica los neutrones pueden acercarse a los nucleos de los a´tomos sin ser repelidos.
En el siguiente video podemos ver el funcionamiento de un reactor nuclear de fision utilizado en la generacion de energía eléctrica
En este otrovideo se recorren las instalaciones de la Central Nuclear de Atucha en la provincia de Buenos Aires , existe otra Central Nuclear en la localidad de Rio Tercero Provincia de Cordoba.
Los diferentes Nucleidos de un mismo Elemento ( se llaman ISOTOPOS y ya vimos el caso d e los 3 isotopos del Elemento Hidrógeno) pueden se "Estables" o "Inestables".
Los Isotopos Inestables ó "radiactivos" tinen muchisimas aplicaciones en Medicina , Industria e Investigación.
En el siguiente video podemos apreciar algunas aplicaciones de los Isotopos radioactivos se aprovecha en algunos casos que poseen las mismas propiedades quimicas que el correspondiente elemento estable ligada a la facil detección debido a la radioactividad que emiten.El contenido de Carbono-14 se emplea para determinar la antiguedad de fosiles.
En este otrovideo se explica el uso de isotopos radioactivos en las "centellografias"
Aqui podemos ver una explicacion acerca de las principales radiaciones emitidas por aquellos nucleidos que son atomos radioactivos. Tambien existen nucleidos que emiten Rayos X.
En este otro video se muestra una recopilacion historica sobre el desarrollo de las primeras bombas atómicas.
El elemento ( natural) que posee mas protones es el Uranio justamente porque más protones hacen mas inestables a los átomos , no es que no puedan existir pero su vida se hace mas corta pues desintegran.Si se tiene en cuenta que el Sistema Solar existe desde hace 4600 millones de años , es imposible que pueda haber en la Tierra elementos que tengan corta vida.Sin embargo existen Elementos ARTIFICIALES producidos en laboratorios que poseen mas protones que el Uranio se llaman "Elementos Transuránicos".Esos Elementos Transuránicos ( mas alla del Uranio) tienen " vidas medias" del orden de milisegundos , esto significa que la mitad de los átomos inicialmente presentes se desintegra en ese cortisimo tiempo.
El Elemento Transuránico mayor valor de Z se pudo sintetizar a la fecha ( 20020 ) posee 118 protones.
lunes, 11 de mayo de 2020
Nucleidos y Ejercicios suplementarios
Vimos que los átomos constan de diferentes combinaciones del numero de protones y de neutrones.Ahora bien, como nombramos los diferentes clases de átomos?
Un nucleido es cada una de las posibles agrupaciones de nucleones (protones y neutrones) ( tambien pueden diferir por la Energia que poseen en su estructura nuclear pero no vamos a considerar eso en este curso).
Se aceptan dos formas de notación para designar un nucleido determinado:
- El símbolo del elemento precedido del número másico como superíndice (ejemplo: 12C).
- El nombre del elemento unido por un guion al número másico (ejemplo: carbono-12)
Simbología
En la expresión de cualquier agrupamiento de nucleones, se tiene que:
- A simboliza el número másico, es decir, la suma del número de protones y el de neutrones.
- Z es el número atómico, coincidente con el número de protones.
- M es el símbolo del elemento químico del átomo correspondiente, ligado a su número de protones.
- En consecuencia, el número de neutrones se deduce a partir del número másico y del número atómico (N = A - Z)
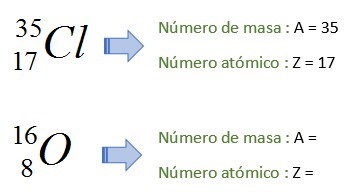
Un nucleido provisto de una secuencia orbital de Z electrones constituye un átomo. Esto propicia que en principio su notación sea idéntica a la notación de los elementos químicos. Así, cada nucleido se denomina según el símbolo del átomo que genera, precedido de los valores A y Z con presuperíndice para A, y presubíndice representativo de Z:
A
Z
| M |


lunes, 4 de mayo de 2020
Ejercicio a entregar ( Parte B)
Responder a las siguientes preguntas ( recordar que cuando digo átomo me refiero a un átomo que tiene todas sus parículas subatómicas).
---1) Un àtomo neutro posee 6 protones y 6 neutrones¿Cuántos electrones posee?
---2) Un atomo neutro posee 11 electrones y 10 neutrones¿Cuánto vale Z?
---3) Un àtomo posee carga eléctrica +1 .Si tiene 10 electrones ¿Cuántos protones tendrá?
---4) Un àtomo posee 10 protones, 10 electrones y 10 neutrones¿Cuánto valen A, Z y N?
---5) Un àtomo posee masa atómica 39 y posee 20 neutrones.¿Cuanto vale Z?
---6) Un átomo posee A= 14 Z= 5 , cuanto vale N?
---7) Un átomo posse Z= 8 N= 8 A= 16 .Ese átomo gana 2 electrones ( los toma ) , como quedan los valores de A, Z y N para ese átomo?Con que carga electrica queda ( tipo y cantidad) ? Es un Anion ó un Cation?
---8) Un átomo posee Z=3 N=3 y A= 6 .Ese átomo pierde 1 electrón ( los cede) .Como quedan A, Z y N ? Con que carga electrica queda ( tipo y cantidad)Es un Anion ó un Cation?
FECHA DE ENTREGA DEL EJERCICIO MARTES 12 DE MAYO DE 2020
---6) Un átomo posee A= 14 Z= 5 , cuanto vale N?
---7) Un átomo posse Z= 8 N= 8 A= 16 .Ese átomo gana 2 electrones ( los toma ) , como quedan los valores de A, Z y N para ese átomo?Con que carga electrica queda ( tipo y cantidad) ? Es un Anion ó un Cation?
---8) Un átomo posee Z=3 N=3 y A= 6 .Ese átomo pierde 1 electrón ( los cede) .Como quedan A, Z y N ? Con que carga electrica queda ( tipo y cantidad)Es un Anion ó un Cation?
FECHA DE ENTREGA DEL EJERCICIO MARTES 12 DE MAYO DE 2020
Estructura atómica
En los capitulos anteriores vimos que podemos considerar ,para los alcances de este curso, que existen 3 partículas subatómicas en el átomo, electrones ( -) , protones ( +) y neutrones ( sin carga eléctrica).Aclaración : El neutron no tiene nada que ver con lo que llamamos "atomo neutro".
En el modelo atómico de Bohr vimos que hay un nucleo (una zona central muy pequeña donde estan los protones ) y por fuera los electrones que ( en este modelo) giran en órbitas circulares.Estas órbitas estan a diferentes distancias del núcleo como si fueran las capas que posee una cebolla.Cuanto más alejadas esten del núcleo poseen mas Energia los electrones que estan en ellas ( pensemos que los protones atraen a los electrones ( cargas opuestas se ...) por consiguiente llevar un electrón desde una capa cercana al nucleo hasta una capa mas alejada implica emplear energía.Esa Energia es Energia Potencial ( existe en potencia , se manifestara al convertirse en otra forma de Energía).
Una de las Leyes de la Naturaleza mas importantes , llamada " Primera Ley de la Termodinámica" dice " La cantidad de Energia del Universo es constante , lo que implica que la Energía no puede crearse ni destruirse, solo puede transformarse". Aplicada a la estructura del átomo fue un concepto fundamental para postular la existencia de las "capas" donde existen los electrones.
Antes de continuar debemos saber que la luz es una " radiacion" , una forma de Energía.La cantidad de Energia que posee depende de su "color" ( el color es una caracteristica de la luz que reconocemos a travez de nuestra vista), en forma cientifica se denomina "longitud de onda" pues se puede considerar a la Energia de la luz como transmitiendose como una "onda" que se propaga en el Espacio.Cada longitud de onda ( color) posee una cantidad de Energia .La Energia de lo que llamamos "color Rojo" es MENOR que la Energia que posee la luz de " color Azul".
En el siguiente video podemos ver una explicacion sobre lo anterior.
En la infografia que sigue se pueden ver las relaciones entre longitud de onda, color y Energia .
Y que tiene que ver la luz con el Modelo atómico de Bohr?Justamente la luz que emiten los átomos cuando son "exitados" ( cuando de les da Energía por medio de calor, choques,radiaciones, ) es la manifestacion de los cambios de Energia que sufren los electrones al cambiar de nivel de capa en el átomo.En el video que sigue veremos un experimento donde se excitan con el calor de una llama,diferentes elementos .A partir del calculo de las Energias involucradas en esos "saltos" de los electrones y de otros datos que se obtuvieron de conocimientos que brindaba la Quimica se fue construyendo el modelo de Capas de electrones que veremos en este curso elemental de Quimica.
Pero que papel juegan los Neutrones? En lo especificamente relacionado con la Quimica el papel es muy pequeño , solo esta relacionado a fenómenos muy sutiles que no viene al caso explicar.En cuanto al por que de su presencia podemos intuirlo a partir de la siguiente observación: Dijimos que el nucleo atómico es muy pequeño y que allí se encuentran los protones.No es extraño? Cual es la contradicción aquí?Piensenlo
Mientras tanto vamos a introducir una serie de convenciones para referirnos sin ambiguedad a una determinada clase de átomo.Las convenciones de nomenclatura son las siguientes:
Z es un número entero que se refiere a la cantidad de protones que posee un átomo
N es un número entero que se refiere a la cantidad de protones que posee un átomo
A es un número entero que se refiere a la cantidad de protones Y neutrones que posee un átomo
A es igual entonces a Z+N
Lo que caracteriza a un átomo desde el punto de vista Químico es la cantidad de protones que posee o
sea, un atomo puede ganar o perder electrones pero el numero de protones permanece constante en las reacciones quimicas.Un ELEMENTO QUIMICO es como dijimos una sustancia simple constituida por una misma Clase de atomos desde el PUNTO DE VISTA QUIMICO, es decir por átomos del mismo valor de Z .Ahora? Que pasa con los átomos que tiene el mismo valor de Z pero distinto valor de N ? Esos átomos se llaman ISOTOPOS , desde el punto de vista quimico se comportan igual. Las diferencias de reaccion son muy sutiles y se ven en los elementos mas "livianos" , o sea los que poseen menor valor de A.
Pregunta , pesaran lo mismo todas las clases de átomos?
Volvamos a A , Z y N, Al numero " A" se lo llama Número Masico
Al numero "N" se lo llama Numero de neutrones
Al numero "Z" se lo llama Numero Atomico
Ejemplos : Un atomo posee 1 neutron y 1 proton
Z= 1 N=1 A=2
Un atomo posee 2 neutrones y 1 proton
Z=1 N=2 A=3
Un átomo posee 1 proton y ningun neutron
Z=1 N=0 A=1
Esos tres átomos representan el mismo ELEMENTO QUIMICO ( el Elemento Hidrógeno) pero son ISOTOPOS entre si
El Elemento Hidrógeno tiene tres isotopos conocidos Protio ( A= 1 ), Deuterio(A=2) y Tritio ( A=3)
Quizas han oido hablar del "Agua pesada" , es Agua que posee Deuterio en vez de Protio
El ISOTOPO mas abundante del Hidrógeno es el protio, representa aproximadamente el 99,985 % de los atomos de Hidrogeno que hay en la Tierra.Hay Isotopos de todos los elementos pero los del Hidrógeno son los únicos Isotopos que tienen nombre propio.
En los ejemplos anteriores no nombre a los electrones, cuando hable de átomo me voy a referir a un átomos que estan "completos" o sea que son electricamente neutros , por eso es obvio que todos los atomos que nombre poseen su electron.
En la provincia argentina de Chubut se encuentra una Planta Industrial de fabricacion de Agua Pesada , como veremos en este link , es la planta de produccion de agua pesada mayor del Mundo.
Pre
Suscribirse a:
Entradas (Atom)


















