Resolucion
1) Como dice en el Blog , para saber el tipo de union "se calcula la DIFERENCIA de Electronegatividad entre los átomos que se uniran,en el resultado , no importa el signo"
En la Tabla del Blog esta el dato de la Electronegatividad que necesitamos, debajo del Simbolo Quimico del cada Elemento esta ese dato

Calculamos para cada molecula :
Agua Diferencia de electronegatividad : 3,5 - 2,1 = 1,4 se trata de una union Polar
Amoniaco " : 3 -2,1 = 0,9 " union Polar
Acido Selenhidrico " : 2,4 - 2,1 = 0,3 " union No Polar
Acido Sulfhidrico " : 2,5 - 2,1 = 0,4 " union No Polar
Acido Clorhidrico " : 3,0 - 2,1= 0,9 " union Polar
Fosfina " : 2,1 - 2,1 = 0,0 " union no Polar
Metano " : 2,5 -2,1 = 0,4 " union no Polar
Aclaracion , como dice " no importa el signo de la cuenta" , ejemplo , es lo mismo calcular 3,5 -1,4 = 0,9 que calcular 1,4 -3,5 = -0,9 al no importar el signo.
Una vez que hicimos ese calculo vemos cual es el criterio para decidir si se trata de una Union Polar o No Polar ó Ionica .
El criterio para decidir que tipo de union se forma está en en esta tabla del Blog

Lo que puede verse es que las moleculas que poseen enlaces Polares ( agua , Amoniaco) hierven en general a temperaturas mas elevadas que las moleculas cuyos atomos poseen enlaces no Polares.
Comparemos por ejemplo el Amoniaco con el Metano.El Amoniaco hierve a 41 °C bajo cero y el metano hierve a 162 °C bajo cero.En el Blog se explica cual es el efecto de la presencia de "polos" sobre la atraccion que sufren las moleculas entre si.
Comparemos el punto de ebullicion del agua H2O ( hierve a 100 °C ) con el de el Acido Sulfhidrico SH2 ( hierve a 60 °C bajo cero) la diferencia entre ellas es que el atomo de Oxigeno posee mayor Electronegatividad y eso hace que el enlace con el atomo de Hidrógeno sea mas Polar.
2) Cuantos átomos de cada elemento hay en las moléculas de cada una de las sustancias anteriores
H2O hay dos atomos de Hidrógeno y un átomo de Oxígeno en cada molécula
NH3 hay tres atomos de Hidrógeno y un átomo de Nitrógeno en cada molécula
SeH2 hay dos atomos de Hidrógeno y un átomo de Selenio en cada molécula
SH2 hay dos átomos de Hidrógeno y un atomo de azufre en cada molécula
ClH hay un atomo de Cloro y un átomo de Hidrógeno en cada molécula
PH3 hay un atomo de Fosforo y 3 átomos de Hidrógeno en cada molécula
CH4 hay una átomo de Carbono y 4 atomos de Hidrógeno en cada molécula
3;4;5y 6 ) Encontrar el tipo de union a partir de los datos de electronegatividad
Cesio y Cloro buscamos la electronegatividad de cada elemento en la Tabla y hacemos la diferencia en este caso seria 3,5 - 0,7 = 2,8 se trata de una union de tipo iónico porque la diferencia es mayor a 1,7
Hacemos lo mismo para el resto
Fluor y Cloro lo mismo 4,0 - 3,0 = 1 se trata de una union de tipo covalente polar
Potasio y Fluor 4,0- 0,8 = 3,2 se trata de una union de tipo iónico
Calcio y Cloro 3,0 -1,0 = 2,0 se trata de una unión de tipo iónico
7) Escribir la Fórmula Quimica de una sustancia que posee un total de 5 atomos :Un atomo de Carbono, dos átomos de Cloro , un atomo de Hidrógeno y un atomo de Fluor
La fórmula de ese compuesto seria CCl2HF Aclaracion : los numeros que indican cuantos atomos de cada elemento hay en cada molécula se ponen como sub- indice. El numero 1 no se pone ( se sobrentiende) , el 2, 3 , 4 , 5 , etc se ponen como sub-indice aqui no se hizo por las caracteristicas de escritura disponibles en este Blog.
8)Escribir la Fórmula Química de una sustancia que posee un total de 7 átomos: Un atomo de azufre, cuatro átomos de Oxigeno y dos átomos de Hidrógeno.
La Formula Química seria SO4H2 , escribiendo la formula con sub-indices seria
H2SO4
Aclaración: Existen reglas para nombrar los compuestos Quimicos , convenciones donde se especifica cual es el orden en que se colocan los elementos, etc pero no vamos a seguir esas reglas que se denominan "Nomenclatura Química".Hay una organizacion Internacional que se ocupa de establcer esas Reglas.
9) Representar por medio de las Estructuras de Lewis la Molecula del gas Nitrógeno ( son dos atomos de Nitrógeno unidos )
Para hacer esta "Estructura de Lewis" , nos fijamos en la Tabla Periodica de los elementos representativos y vemos que el elemento Nitrógeno está ubicado en el Grupo V , ,lo que significa como vimos que posee 5 electrones en su capa electrónica mas externa.Para llegar a la estructura del Gas Inerte mas cercano, cada atomo debe compartir 3 electrones con el otro.
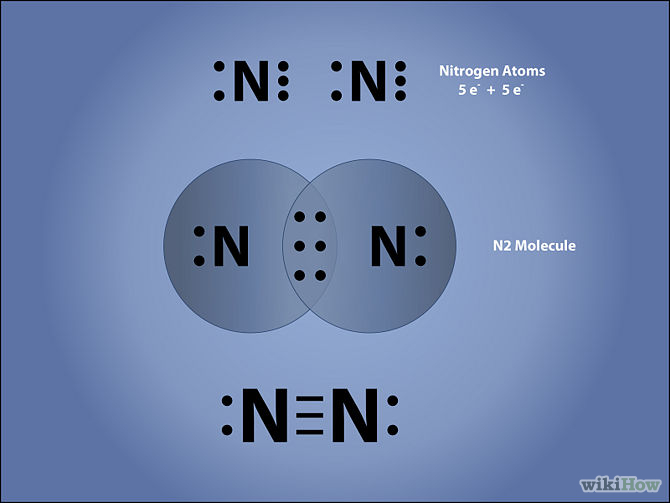
Aqui podemos ver tres formas de representacion de esa molécula de Nitrógeno, una es la de Lewis ( la pelotitas que representan a los electrones de la capa mas externa).Otra es la "formula molecular o formula quimica) donde los subindices dicen cuatos atomos hay de cada elemento. La otra es la fórmula desarrollada ó estructural donde cada par de electrones de union se representan con un guionó "rayita".La razon de que haya 3 tipos de representaciones se debe a que se utilizan segun la necesidad.
N2 esta es la formula quimica ó molecular
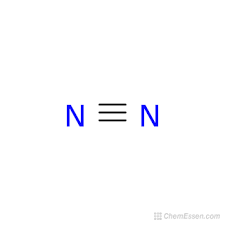 La de arriba seria una representación de la "formula desarrollada " ó "estructural" , vemos que cada par de electrones de union en la representacion de Lewis se transformó ahora en una rayita
La de arriba seria una representación de la "formula desarrollada " ó "estructural" , vemos que cada par de electrones de union en la representacion de Lewis se transformó ahora en una rayita
10) Representar por medio de Estructuras de Lewis la Molécula de Fosfina y la Molécula de acido Clorhidrico.
La Fosfina , el atomo de Fosforo ( Grupo V ) necesita 3 electrones para llegar a tener 8 y los obtiene compartiendo con 3 atomos de Hidrógeno.A su vez el Hidrógeno al compartir un electron adquiere la estructura electrónica externa similar al Helio como ya vimos anteriormente.

A la izquierda vemos la estructura de Lewis de la Fosfina y a la derecha la Formula desarrollada .En este caso se puso ademas una rayita simbolizando ese par de electrones que no se comparten.
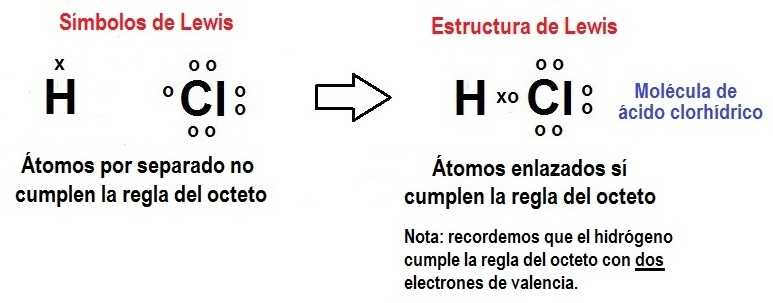
Arriba vemos la representacion de Lewis de la Molecula de Acido Clorhidrico.El atomo de Cloro ( Grupo Vll) posee 7 electrones en su capa mas externa y necesita uno mas para llegar a 8 , lo obtiene compartiendo uno con el atomo de Hidrógeno.A su vez el Hidrógeno al compartir un electron adquiere la estructura electrónica externa similar al Helio como ya vimos anteriormente.
La formula Quimica ó molecular es HCl
La Fórmula desarrollada ó estructural es H-Cl
















